 |
| Ilustrasi gerak partikel gas |
Pembahasan soal-soal Ujian Nasional (UN) SMA-IPA bidang studi Fisika dengan materi pembahasan Teori Kinetik Gas yang meliputi:
- persamaan umum gas ideal,
- hubungan antara suhu gas terhadap energi kinetik gas, serta
- gerak partikel gas.
Soal Teori Kinetik Gas UN 2011
Sejumlah gas ideal berada di dalam ruangan tertutup mula-mula bersuhu 27 °C. Supaya tekanannya menjadi 4 kali semula, suhu ruangan tersebut haruslah ….
A. 108 °C
B. 297 °C
C. 300 °C
D. 927 °C
E. 1.200 °C
A. 108 °C
B. 297 °C
C. 300 °C
D. 927 °C
E. 1.200 °C
Pembahasan
Persamaan umum gas ideal adalah:PV = nRT
Gas ideal berada pada ruang tertutup berarti volume gas sebelum dan sesudah dipanaskan adalah tetap (V konstan). Sementara itu nilai n (jumlah mol gas) juga tetap karena tidak penambahan massa gas. Sedangkan R memang tetapan. Dengan demikian, persamaan di atas berlaku perbandingan:
P ~ T
Berdasarkan perbandingan senilai di atas, jika P dijadikan 4 kali semua maka otomatis T akan menjadi 4 kali semula juga.
T2 = 4T1
Notasi suhu pada persamaan di atas menggunakan huruf besar (T) berarti besaran suhu harus bersatuan Kelvin.
T1 = (27 + 273) K
= 300 K
Nah, sekarang nilai T2 akan menjadi:
T2 = 4 × 300 K
= 1200 K
= (1200 − 273) °C
= 927 °C
Jadi, agar tekanannya menjadi 4 kali semula, suhu ruangan tersebut haruslah 927 °C (D).
Soal Teori Kinetik Gas UN 2014
Pada kondisi awal partikel gas yang berada dalam ruang tertutup memiliki tekanan P, volume V, dan suhu T. Jika gas volumenya diubah menjadi 3/4 V dan suhu diubah menjadi 2T maka perbandingan tekanan awal dengan tekanan setelah V dan T diubah adalah ....
A. 2 : 3
B. 3 : 2
C. 3 : 4
D. 3 : 8
E. 8 : 3
A. 2 : 3
B. 3 : 2
C. 3 : 4
D. 3 : 8
E. 8 : 3

Pembahasan
Data yang diketahui pada soal:P1 = P
V1 = V
T1 = T
V2 = 3/4 V
T2 = 2T
Berdasarkan persamaan umum gas ideal:
PV = nRT
diperoleh perbandingan:
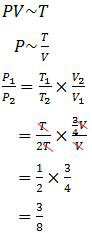
= 3 : 8
Jadi, perbandingan antara tekanan awal dengan tekanan setelah V dan T diubah adalah 3 : 8 (D).
Soal Teori Kinetik Gas UN 2010
Suatu gas ideal mula-mula menempati ruang yang mempunyai volume V, suhu T, dan tekanan P. Jika suhu gas menjadi 2T dan tekanan menjadi 3/2 P maka volume gas akan menjadi …
A. 3/4 V
B. 4/3 V
C. 3/2 V
D. 2V
E. 3V
A. 3/4 V
B. 4/3 V
C. 3/2 V
D. 2V
E. 3V
Pembahasan
Diketahui:V1 = V
T1 = T
P1 = P
T2 = 2T
P2 = 3/2 P
Perbandingan antara P, V, dan T dari persamaan umum gas ideal adalah:
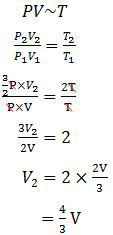
Jadi, volume gas tersebut ketika suhunya diubah menjadi 2T dan tekanannya menjadi 3/2 P adalah 4/3 V (B).
Soal Teori Kinetik Gas UN 2011
Faktor-faktor yang memengaruhi energi kinetik gas di dalam ruangan tertutup:
1) tekanan
2) volume
3) suhu
4) jenis zat
Pernyataan yang benar adalah ….
A. 1 dan 2
B. 1 dan 3
C. 1 dan 4
D. 2 saja
E. 3 saja
1) tekanan
2) volume
3) suhu
4) jenis zat
Pernyataan yang benar adalah ….
A. 1 dan 2
B. 1 dan 3
C. 1 dan 4
D. 2 saja
E. 3 saja
Pembahasan
Energi kinetik gas dalam ruangan tertutup dirumuskan sebagai:Ek = 3/2 kT
sehingga
Ek ~ T
Jadi, energi kinetik gas dalam ruangan tertutup hanya dipengaruhi oleh suhu (E).
Soal Teori Kinetik Gas UN 2010
Suhu gas ideal tabung dirumuskan sebagai Ek = 3/2 kT dengan T menyatakan suhu mutlak dan Ek adalah energi kinetik rata-rata molekul gas.
Berdasarkan persamaan di atas …
A. semakin tinggi suhu gas, energi kinetiknya semakin kecil
B. semakin tinggi suhu gas, gerak partikel gas semakin lambat
C. semakin tinggi suhu gas, gerak partikel gas semakin cepat
D. suhu gas berbanding terbalik dengan energi kinetik gas
E. suhu gas tidak memengaruhi gerak partikel gas
Berdasarkan persamaan di atas …
A. semakin tinggi suhu gas, energi kinetiknya semakin kecil
B. semakin tinggi suhu gas, gerak partikel gas semakin lambat
C. semakin tinggi suhu gas, gerak partikel gas semakin cepat
D. suhu gas berbanding terbalik dengan energi kinetik gas
E. suhu gas tidak memengaruhi gerak partikel gas
Pembahasan
Berdasarkan rumus yang disajikan pada soal, diperoleh hubungan:Ek ~ T
Dari hubungan antara energi kinetik dan suhu di atas dapat disimpulkan:
- energi suhu gas berbanding lurus dengan energi kinetik gas [opsi D salah]
- semakin tinggi suhu gas, energi kinetiknya semakin besar [opsi A salah]
Ek = 1/2 mv2
Jika dikaitkan dengan energi kinetik gas maka diperoleh:
Ek = 3/2 kT
1/2 mv2 = 3/2 kT
Sehingga diperoleh hubungan:
v2 ~ T
Hubungan ini berarti:
- suhu gas akan memengaruhi gerak (kecepatan) partikel [opsi E salah]
- semakin tinggi suhu gas, gerak partikel semakin cepat [opsi B salah, opsi C benar]
Pembahasan Soal Teori Kinetik Gas yang lain bisa dilihat di:
Pembahasan Fisika UN 2014 No. 18.
Pembahasan Fisika UN 2016 No. 21 dan 22
Pembahasan Fiiska UN 2017 No. 25
Pembahasan Fisika UN 2018 No. 24 dan 25
Pembahasan Fisika UN 2019 No. 26
Simak juga, Pembahasan Fisika UN: Gelombang.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

Very good, very help me.
ReplyDeleteThanks, Hanif
DeleteVery good🤩
ReplyDeleteTerima kasih. Semoga berkah dan manfaat
Delete